在个性化医学时代,预测性生物标志物在临床决策中具有重要作用,尤其是在肿瘤治疗中【1】。虽然将生物标志物纳入临床试验可以显著提高治疗的响应率,但针对新一代癌症治疗的强大预测性生物标志物仍未得到充分开发或难以确定【2】。现有生物标志物对免疫检查点抑制剂(Immune checkpoint inhibitors,ICI)治疗效果的预测能力有限,并且常常需要进行难以获取的组织活检,因此无法准确对患者进行分层【3-4】。虽然最近的研究集中在免疫系统的各个方面,但找到适用于多种癌症类型、准确预测ICI疗效的生物标志物仍然是一个至关重要但尚未满足的需求。
近日,来自以色列理工学院拉帕波特医学院的Yuval Shaked和Tim J. Cooper共同在Cancer Cell期刊发表题为Interferon-stimulated neutrophils as a predictor of immunotherapy response(干扰素刺激的中性粒细胞作为免疫疗法反应的预测因子)的文章。研究发现了一种新的血源性生物标志物Ly6Ehi中性粒细胞,它可在小鼠模型中预测抗PD1治疗的疗效。研究人员还证实,在非小细胞肺癌和黑色素瘤患者中,该生物标志物也能精准地预测免疫疗法的反应,具有很高的潜在临床应用价值。

研究人员利用单细胞RNA测序和临床前肿瘤模型结合的方法,通过识别与免疫治疗反应相关的细胞状态,发现了一种新的生物标志物——干扰素诱导的Ly6E高表达中性粒细胞Ly6Ehi。这些中性粒细胞由肿瘤固有的STING信号诱导产生,在小鼠和人类肿瘤中,作为肿瘤浸润和血液中的预测性免疫治疗生物标志物,具有良好的预测性能。研究人员通过数据分析得到了由15个基因组成的Ly6E高表达基因标记,能够准确地对治疗响应者和非响应者进行有效分层。研究还展示了Ly6Ehi中性粒细胞亚型的功能特征,揭示了它们可以直接促使肿瘤对抗PD1治疗重新变得敏感。
Ly6Ehi中性粒细胞的鉴定和功能
首先,研究人员使用稳定且可预测的4T1乳腺癌模型,寻找预测免疫治疗反应的生物标志物。实验人员构建了两种细胞系,即4T1M(抗PD1治疗敏感细胞系)和4T1P(抗PD1治疗耐药细胞系),以便研究。他们发现一种特定亚型的中性粒细胞与抗PD1的治疗反应和干扰素刺激有关。单细胞RNA测序结果分析显示,在抗PD1治疗敏感的肿瘤中,这种中性粒细胞亚群数量显著增加,并且有192个基因表达上调,为发现潜在的生物标志物提供了可能性。为了筛选出可靠的生物标志物,研究人员强调了选择生物标志物的几个重要标准,包括对标志物机制的理解、标志物的肿瘤内在诱导、表达稳定性以及可通过简单的流式细胞术进行分析等。按此逻辑,研究人员通过单细胞RNA测序技术对中性粒细胞进行轨迹分析,发现了一个分支的双谱系轨迹,其中中性粒细胞通过IFN信号的作用进一步分化为终末状态,并与免疫疗法的反应相关。研究人员筛选了所有差异表达的基因,并确定了Ly6E作为细胞表面标记物,满足了选择生物标志物的标准,可以作为预测免疫治疗反应的候选生物标志物。研究还发现,Ly6Ehi中性粒细胞在肿瘤和血液样本中的比例与免疫治疗反应显著相关,这表明将Ly6Ehi中性粒细胞作为血液源性的生物标志物用于预测免疫治疗反应是可行的。
然后,研究人员在体外使用IFNα/γ的混合物刺激GR1+细胞(小鼠单核细胞和粒细胞),人工诱导Ly6Ehi中性粒细胞的产生,并验证了这些细胞与体内分离Ly6Ehi中性粒细胞的相似性。随后,他们将体外诱导的Ly6Ehi中性粒细胞移植到小鼠体内,观察它们对免疫抑制剂(如PD1抗体)耐受肿瘤的影响。结果显示,IFNα/γ诱导的Ly6Ehi中性粒细胞治疗可以显著减少耐药肿瘤的生长,并增加活化的细胞毒性CD8+ T细胞数量。相比之下,单独使用IFN-γ和IFN-α无法实现相同的效果(图1E)。然而,IFNα/γ在全身治疗时可能会产生多向效应,抑制免疫治疗反应,并抵消Ly6Ehi中性粒细胞克服耐药肿瘤细胞的能力。此外,研究还发现Ly6Ehi中性粒细胞本身具有独立且显著的抗肿瘤效应。这些结果突显了Ly6Ehi中性粒细胞在克服免疫治疗耐药性方面的潜在作用,具有重要的临床应用意义。
Ly6Ehi中性粒细胞的抗肿瘤机制
考虑到肿瘤细胞STING信号通路活性及其在肿瘤细胞分泌IFN(如IFN-α)中的作用,研究人员进一步考察Ly6Ehi中性粒细胞的产生和功能是否与STING信号通路的调控有关。他们验证了在肿瘤微环境中,胞浆内双链DNA的产生能够激活STING信号通路,并促使Ly6Ehi中性粒细胞的产生和IFN的释放。与非响应性的4T1P细胞相比,响应性的4T1M癌细胞胞浆内双链DNA水平更高,STING及其下游信号通路成分表达上调。此外,4T1M细胞分泌的IL-6水平更高,MHCI表达增加、PDL1表达降低,这些都是STING激活的标志。研究人员使用STING抑制剂H151成功逆转了这种现象。研究还发现,4T1M细胞的条件培养基在体外以STING依赖的方式强烈诱导Ly6Ehi中性粒细胞的表型,并且这种诱导作用在IFN受体阻断的情况下被逆转。这些发现表明,STING信号通路的激活,作为响应性癌细胞的内在特性,是IFN诱导的Ly6Ehi中性粒细胞产生的主要机制。所以Ly6Ehi中性粒细胞能够预测免疫治疗反应。此外,Ly6Ehi中性粒细胞通过分泌细胞因子如IL-12b,直接激活细胞毒性CD8+ T细胞,促进抗肿瘤免疫。研究人员还在多种模型中验证了Ly6Ehi中性粒细胞作为血液生物标志物的有效性。研究结果表明,Ly6Ehi中性粒细胞的比例可以预测抗PD1的治疗反应,包括由肿瘤依赖、宿主依赖或种系特异性差异驱动的多种治疗反应预测。因此,Ly6Ehi中性粒细胞是一个潜在的“泛机制”标志物,肿瘤微环境中的IFN分泌可能是治疗反应机制中的一个共同步骤。
Ly6Ehi中性粒细胞准确预测免疫治疗反应
为了排除物种差异对研究结果的影响和转化,研究人员使用临床前模型验证Ly6Ehi中性粒细胞在人类中的保留程度。通过分析公开的单细胞RNA测序数据,研究人员发现这一标志物在人类中具有类似的IFN刺激诱导的细胞状态,并且与免疫治疗反应和临床结果密切相关。随后,他们对非小细胞肺癌患者和恶性黑素瘤患者外周血单核细胞中Ly6Ehi中性粒细胞的水平进行量化,发现高水平的Ly6Ehi中性粒细胞与治疗反应和临床结果呈强相关性,有效区分了非响应者和响应者。进一步的分析也证实了Ly6Ehi中性粒细胞在多种人类肿瘤类型中具有预测免疫治疗反应的能力。综合来看,这些结果表明Ly6Ehi中性粒细胞的水平在多种人类肿瘤类型中可以作为免疫治疗反应的预测性生物标志物。
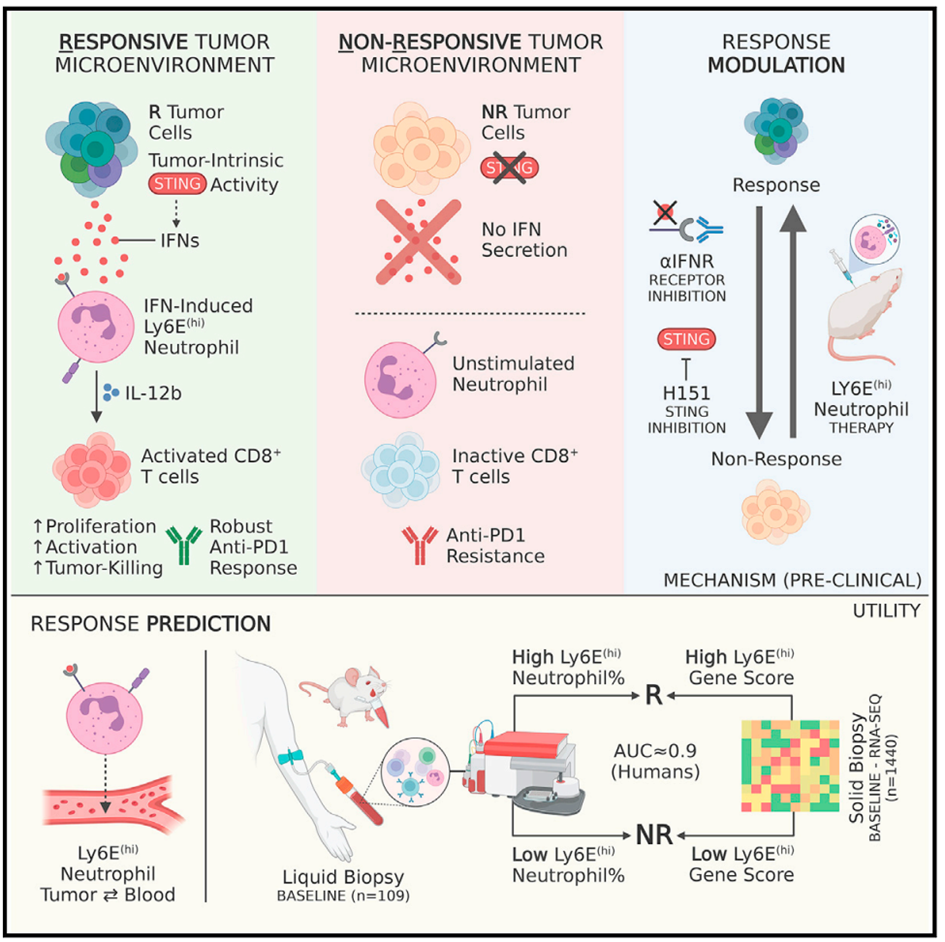
综上所述,该研究确定了干扰素诱导的Ly6Ehi中性粒细胞可作为小鼠抗PD1治疗反应的血液生物标志物。这些中性粒细胞由肿瘤固有的STING信号通路激活诱导产生,使耐药肿瘤对抗PD1治疗敏感。非小细胞肺癌和黑素瘤的临床前分析结果证明了Ly6Ehi中性粒细胞在人类肿瘤中可以高度准确预测免疫治疗反应的能力,显示出强大的临床应用潜力。
原文链接:https://doi.org/10.1016/j.ccell.2023.12.005
参考文献
1. Schwaederle, M., Zhao, M., Lee, J.J., Lazar, V., Leyland-Jones, B., Schilsky, R.L., Mendelsohn, J., and Kurzrock, R. (2016). Association of Biomarker-Based Treatment Strategies With Response Rates and Progression-Free Survival in Refractory Malignant Neoplasms: A Meta-analysis. JAMA Oncol. 2, 1452-1459.
2. Robert, C. (2020). A decade of immune-checkpoint inhibitors in cancer therapy. Nat. Commun. 11, 3801.
3. Valero, C., Lee, M., Hoen, D., Zehir, A., Berger, M.F., Seshan, V.E., Chan, T.A., and Morris, L.G.T. (2021). Response Rates to Anti-PD-1 Immunotherapy in Microsatellite-Stable Solid Tumors With 10 or More Mutations per Megabase. JAMA Oncol. 7, 739-743.
4. Lu, S., Stein, J.E., Rimm, D.L., Wang, D.W., Bell, J.M., Johnson, D.B., Sosman, J.A., Schalper, K.A., Anders, R.A., Wang, H., et al. (2019). Comparison of Biomarker Modalities for Predicting Response to PD-1/ PD-L1 Checkpoint Blockade: A Systematic Review and Meta-analysis. JAMA Oncol. 5, 1195-1204.













